научное издание МГТУ им. Н.Э. Баумана
НАУКА и ОБРАЗОВАНИЕ
Издатель ФГБОУ ВПО "МГТУ им. Н.Э. Баумана". Эл № ФС 77 - 48211. ISSN 1994-0408
# 10, октябрь 2013
DOI: 10.7463/1013.0645537
УДК 536.2; 004.02
Россия, ВолГУ (Волгоград)
Введение
При расчетах безопасного уровня теплового воздействия на биоткань желательно иметь данные по начальному распределению температуры при заданной температуре окружающей среды. Нахождение такого распределения сталкивается с определенными трудностями, так как необходимо учитывать ряд специфических для живых тканей факторов, таких как микроциркуляция крови (перфузия), клеточный метаболизм, наличие биологических механизмов терморегуляции. Даже теплообмен с окружающей средой имеет свои особенности. Например, для кожи, строго говоря, необходимо учитывать все известные механизмы теплоотдачи: теплопроводность, испарение, конвективный и радиационный механизмы. Но обычный подход, применяемый в работах, посвященных теплобмену в живых тканях [1, 2], состоит в использовании одного коэффициента теплоотдачи и граничного условия третьего рода (закон теплоотдачи Ньютона). Между тем очевидно, что даже для одного индивида величина этого коэффициента будет зависеть как от условий внешней среды, так и от внутреннего состояния организма. Использование заранее заданного коэффициента теплоотдачи, для разных индивидов, даже находящихся в одинаковых (комфортных) условиях окружающей среды, по-видимому, не является корректным, т.к. индивидуальные особенности строения кожи (количество бороздок, волосяной покров и пр.) приведут к разбросу значения этого коэффициента (судя по имеющимся в литературе данным – в несколько раз).
Для ряда теплофизических параметров, таких как перфузия, теплопроводность, термическая диффузия, найдены некоторые способы экспериментального определения/оценки этих величин для биотканей [2-4]. Что касается плотности биологических источников тепла, то имеющиеся данные по ряду живых тканей описывают только усреднённую метаболическую составляющую источников. По мнению автора, использование этих предопределенных величин не может быть рекомендовано в каждом конкретном случае (по тем же причинам, что и для коэффициента теплоотдачи).
В данной работе для описания стационарного теплового состояния живой ткани предпринят более гибкий подход, заключающийся в расчетном методе нахождения плотности мощности эквивалентных источников тепла, включающих в себя как метаболические источники, так и эффективные, образуемые, как полагает автор, вблизи поверхности живой ткани из-за локальной неоднородности параметров теплообмена. Кроме того, предложено коэффициент теплоотдачи не использовать как жестко заданный параметр, а рассчитывать по измеренному потоку тепла в каждом конкретном случае. Как показано в статье, данный подход позволяет находить как модельную функция плотности источников тепла, так и коэффициент теплоотдачи для конкретных условий окружающей среды и конкретного индивида, что позволяет в итоге определить искомое температурное распределение.
1. Описание модели
Для живых тканей обычно используют уравнение, которое является частным случаем уравнения Пеннеса [5], и для стационарного состояния имеет вид:
![]() (1)
(1)
где K – коэффициент теплопроводности, U - искомая температура ткани, ρb - плотность крови (ρb = 1060 кг/м3), Сb- теплоемкость крови (Сb = 3770 Дж кг−1 K−1), Ub – температура крови, ωb – объёмная перфузия крови в данной ткани (размерность м3(крови) с−1 м−3(ткани)), S(r) - функция плотности мощности метаболических источников тепла в среде (Вт/м3). По мнению автора данной статьи, уравнение (1) лишь приближенно описывает теплообмен в реальной биоткани по следующим очевидным причинам: эффективность теплопередачи от крови к ткани неравномерна по глубине, температура крови не есть константа, температура венозной крови не обязательно совпадает с локальной температурой ткани. Капиллярная сеть разветвляется у поверхности биоткани, при этом часть капиллярного русла в норме может быть отключена (специальными мышцами -капиллярными сфинктерами), но может действовать для ткани как дополнительный источник тепла, т.к. термически контактирует с остальной сетью и артериолами. В кожной биоткани на капиллярный кровоток влияют, помимо изменяющихся метаболических потребностей клеток, ещё и изменения внешней температуры, т.к. в коже присутствуют специфические терморецепторы [6]. Введение неоднородных параметров, да ещё зависящих от внешних условий, в уравнение (1) усложнит его и затруднит решение. В разработанной автором модели параметр Ub считается константой, но имеет несколько иной смысл – это установившаяся температура в глубине биоткани. Этот параметр допускает прямое измерение, например радиотермометрическим методом. Фактическое изменение параметров теплообмена с кровотоком вблизи поверхности биоткани в модели заменяется эквивалентными фиктивными источниками тепла, расположенными в поверхностном слое некоторой толщины. Далее, поскольку в нормальных условиях роль собственных метаболических источников считается незначительной по сравнению с влиянием кровотока, то их также можно ограничить слоем, в котором сосредоточены фиктивные источники, и рассчитывать их совокупность. Тогда можно ограничиться одномерным случаем полу-бесконечной среды, причем биоткань может быть как однослойной, так и многослойной, где каждый слой имеет свой набор параметров. Обозначив M = ωbρbCb, получим стационарное уравнение для слоя lмодели:
 (2)
(2)
где Kl и Ml- значения K и M в слое l. В отличие от уравнения (1) здесь S(z) – модельная функция эквивалентных источников, включающих и (слабые) метаболические. Современные радиотермометрические методы способны определить глубинную температуру Ub с хорошей точностью [7]. Поэтому автором эта величина была выбрана в качестве одного из параметров модели. В качестве второго параметра использовалась измеряемая экпериментально величина плотности теплового потока q1 от поверхности биоткани в окружающую среду. Третьим параметром является также легко измеряемая (в том числе бесконтактными методами) температура поверхности живой ткани U1, а четвертым параметром – температура окружающей среды U0. Для определенности будем рассматривать живую ткань как двухслойную среду с толщинами слоев L1 и L2, где первый слой выполняет защитно-разделительную функцию и в нем отсутствует кровоток и источники метаболического тепла. Например, для кожи таким слоем является эпидермис (толщина от 0,08 мм до 2 мм). Модельная функция плотности биологических источников тепла тогда будет начинаться на границе первого и второго слоя и будет отлична от нуля в слое некоторой толщины L ≤ L2. Таким образом, в модели присутствуют ещё два настраиваемых для конкретных условий (Ub, q1, U1, U0) внутренних параметра: плотность мощности эквивалентных источников тепла S и толщина слоя этих источников L. Они найдутся из условия совпадения рассчитываемой в модели температуры на поверхности биоткани с измеренной на опыте (U1), а также из условия совпадения рассчитываемой температуры на границе слоя источников с глубинной температурой биоткани (Ub). На теплообмен биоткани с окружающей средой в модели накладывается следующее условие, гарантирующее однозначность решения: поток тепла при неизменных внешних условиях однозначно определяется поверхностной температурой U1, как например в граничном условии 3-го рода:
 (3)
(3)
где q1 - плотность потока тепла с поверхности, K1 - коэффициент теплопроводности первого слоя (граничащего с окружающей средой), α - коэффициент теплоотдачи на границе биоткани и окружающей среды, U0 – температура окружающей среды. На другой границе по условиям модели имеем установившуюся температуру:
 (4)
(4)
Необходимо также обеспечить очевидное равенство температур на соприкасающихся границах слоев биоткани и непрерывность потока тепла:
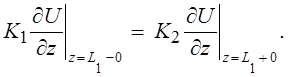 (5)
(5)
2. Дискретизация модели
Для численного решения уравнения (2) подходит метод конечных разностей, который приводит к разностной схеме в “трёхдиагональной” форме:
 (6)
(6)
где Sk и Uk – значения S(z) и U в узлах сетки zk=k×h, k=0,1,2...N, N=(L1+L)/h, h - шаг сетки. Далее, система (6), совместно с дискретными аналогами граничных условий по потокам для граничных узлов сетки (3)-(5), решается многократно, быстрым алгоритмом прогонки, с автоматическим подбором значения Sc шагом dS и Lc шагом h, пока не будут выполнены неравенства:

ε – задаваемая погрешность, по достижению которой итерационный процесс останавливается. После этого уравнение (2), с уже найденными S и L, решается ещё раз, но уже для расширенной области L1+L2, с целью проверки независимости решения от L2 и для получения температурной кривой для всей биоткани. При выборе ε=0,01°C, dS=1 Вт/м3, h=0,1 мм для области ~ 100 мм весь расчет занимает несколько секунд на современных процессорах (при корректном задании исходных параметров модели).
3. Валидация численной модели
Для того чтобы убедиться в корректности решения, даваемого численной моделью, найдем аналитическое решение уравнения (2) для однослойной биоткани толщиной L1 с описанными граничными условиями. В области 0 ≤ z ≤ L совместимое с граничными условиями решение будет иметь вид:
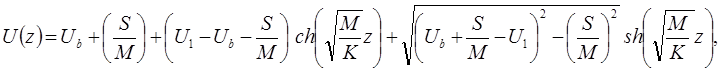 (4)
(4)
где S и L выражается через введенные ранее параметры:

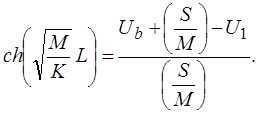
В области L ≤ zU(z)=Ub. Таким образом, имеем единственное решение (рисунок 1).
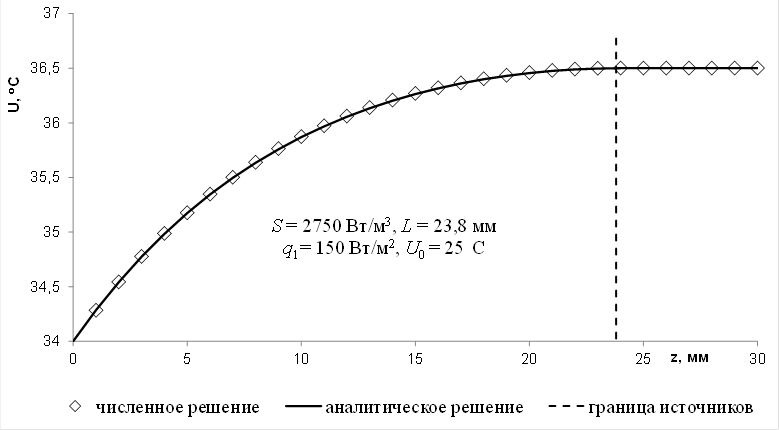
Рис. 1 – сравнение численного и аналитического решений для однослойной биоткани:
K= 0,5 Вт/м×К, M= 5000 Вт/м3×К, α = 16,7 Вт/м2∙К, U1=34°C, Ub=36,5°C
На рисунке 2 показан рассчитанный ход температурной кривой для двухслойной биоткани с нулевыми источниками и нулевой перфузией в первом слое, моделирующей эпидермис и подкожную ткань. В соответствии с уравнением (2), в первом слое численная модель показала линейное возрастание температуры с глубиной.
Таким образом, если в глубине биоткани поддерживается постоянная температура, то на границе рассчитанного в модели слоя эквивалентных источников температура достигает глубинной и далее уже не меняется. Модель предсказывает глубину установления температуры в подкожной ткани 2-3 см (при комфортных внешних условиях). По-видимому, аналогичный ход кривой для глубинной температуры (в норме) показывают и прямые радиотермометрические методы (рисунок 3).

Рис. 2 – численное решение для двухслойной биоткани: L1=2 мм, K1=0,24 Вт/м×К, α =15 Вт/м2∙К, S1=0 Вт/м3, M1=0 Вт/м3×К, K2=0,5 Вт/м×К, M2=5000 Вт/м3×К, U1=33 °C, Ub=36,5 °C

Тк –температура кожи, Твн – глубинная внутренняя температура
Рис. 3 – температурный профиль в норме и при наличии аномалии в глубине [7]
Также нужно отметить следующий факт: если рассчитать температурное распределение по исходной модели Пеннеса, приняв во внимание только перфузию крови и равномерно распределенные метаболические источники (порядка или меньше 1000 Вт/м3 [8]), то глубина установления температуры получается примерно в 2,5-3 раза больше, чем на рисунках 1-3. Далее, поскольку всё изменение температуры в представленной модели приходится на оболочку вблизи поверхности биоткани, то такую модель можно назвать моделью «оболочечных источников». Но в конкретных условиях (задаваемых внешними параметрами, при которых образуются слабые эквивалентные источники), как показали расчеты, представленная модель может расширить область источников на всю биоткань (L=L1 – для однослойной биоткани или L=L2 - для двухслойной биоткани). Таким образом, первоначальную модель Пеннеса (слабые метаболические источники, равномерно распределенные по объему) можно рассматривать как частный случай представленной модели.
Выводы
В данной статье предпринята попытка адаптивного подхода к описанию стационарного термического состояния живой ткани. Представлена теплофизическая модель, основанная на таком подходе. По теоретическому исследованию и вычислительным экспериментам, представленным в статье, можно сделать следующие выводы:
(1) В качестве исходных параметров при моделировании теплового состояния живых тканей нужно использовать величины, допускающие надежное экспериментальное определение при достигнутом уровне техники. В качестве таких параметров в представленной модели использованы внутренняя глубинная температура, плотность теплового потока с поверхности, поверхностная температура и температура окружающей среды.
(2) Коэффициент теплоотдачи с поверхности живой ткани и производительность биологических источников тепла не следует считать наперед заданными величинами, наоборот, они должны рассчитываться в каждом конкретном случае исходя из значений выбранных исходных параметров.
(3) Представленная математическая модель допускает эффективную численную реализацию, прошедшую процедуру валидации на найденном аналитическом решении для частного случая.
(4) Введение концепции эквивалентных источников, расположенных в оболочке вблизи поверхности живой ткани, позволило объяснить и смоделировать профили глубинной температуры в подкожной ткани. В частности, получены соответствующие экспериментальным (радиотермометрическим) данным глубины установления внутренней температуры в теле человека.
Стационарное распределение температуры, даваемое представленной моделью, в частности позволяет корректно задавать начальные и граничные условия при решении нестационарных задач расчета теплового воздействия на живую ткань от внешнего источника тепла (лазеры, микроволны, сфокусированный ультразвук и др.) и соответственно, точнее определять величину (дозу) такого воздействия. Кроме того, ещё одним практическим применением представленной модели может быть её использование для моделирования термического взаимодействие живой ткани с внешними телами, например, различного рода датчиками, для расчета теплового режима их работы и оптимизации конструкции.
Список литературы
1. Sharma P.R., Ali S., Katiyar V.K. Transient heat transfer analysis on skin surface and inside biological tissue // Int. J. of Appl. Math and Mech. 2009. Vol. 5, no. 5. P. 36-47.
2. Yue K, Zhang X, Zuo YY. Noninvasive method for simultaneously measuring the thermophysical properties and blood perfusion in cylindrically shaped living tissues // Cell Biochem Biophys. 2008. Vol. 50, no. 1. P. 41-51. DOI: 10.1007/s12013-007-0038-1
3. Fujii M., Zhang X., Fujino T., Ohkusu M. A Method for in vivo measurement of thermophysical properties of biological tissues // Journal of International Society of Life Information Science. 1999. Vol. 17, no. 1. P. 129-134.
4. Mudaliar A.V. Development of a phantom tissue for blood perfusion measurement and noninvasive blood perfusion estimation in living tissue: PhD Diss. Blacksburg, Virginia Polytechnic Institute and State University, 2007.
5. Pennes H.H. Analysis of tissue and arterial blood temperatures in the resting forearm // J. Appl. Physiol. 1948. Vol. 1, no. 2. P. 93-122.
6. Диверт В.Э. Периферическая терморецепция при различных функциональных состояниях организма: автореф. дис. … докт. биол. наук. Новосибирск, 2008.
7. Основы радиотермометрии. Устройство и правила эксплуатации медицинского радиотермометра РТМ-01-РЭС. Режим доступа: http://www.resltd.ru/rus/literature/lecture1.htm (дата обращения 01.09.2013).
8. Ciesielski M., Mochnacki B., Szopa R. Numerical modeling of biological tissue heating. Admissible thermal dose // Scientific Research of the Institute of Mathematics and Computer Science. 2011. Vol. 1, no. 10. P. 11-20.
Публикации с ключевыми словами: моделирование биоткани, перфузия, биологические источники тепла
Публикации со словами: моделирование биоткани, перфузия, биологические источники тепла
Смотри также:
Тематические рубрики:
| Авторы |
| Пресс-релизы |
| Библиотека |
| Конференции |
| Выставки |
| О проекте |
| Телефон: +7 (915) 336-07-65 (строго: среда; пятница c 11-00 до 17-00) |
|
||||
| © 2003-2024 «Наука и образование» Перепечатка материалов журнала без согласования с редакцией запрещена Тел.: +7 (915) 336-07-65 (строго: среда; пятница c 11-00 до 17-00) | |||||



