научное издание МГТУ им. Н.Э. Баумана
НАУКА и ОБРАЗОВАНИЕ
Издатель ФГБОУ ВПО "МГТУ им. Н.Э. Баумана". Эл № ФС 77 - 48211. ISSN 1994-0408
# 04, апрель 2012
УДК 504.064.36
МГТУ им. Н.Э. Баумана
Отсутствие или недостаточный уровень питательных веществ или наличие загрязнителей в почве приводит к стрессовым ситуациям для растений и невозможности их нормального роста. Такие стрессовые ситуации сложно идентифицировать на ранних стадиях по внешнему виду растений. Поэтому важным является разработка методов и приборов обнаружения стрессовые ситуации растений, как индикаторов недостаточного уровня питательных веществ или наличия загрязнителей в почве.
Эффективным дистанционным или неконтактным методом обнаружения стрессовых состояний растительности может стать метод лазерной индуцированной флуоресценции [1-11].
В настоящее время появляются отдельные экспериментальные работы, посвященные регистрации в лабораторных или в натурных условиях спектров лазерной индуцированной флуоресценции растений при воздействии на них различных стрессовых ситуаций.
Структурная схема типичного флуоресцентного лидара (дистанционного флуориметра) для контроля состояния растительности представлена на рис. 1.
Лазер флуориметра облучает исследуемый растительный объект. При взаимодействии с растительностью лазерный пучок частично рассеивается без изменения длины волны, а часть энергии поглощается и преобразуется в излучение флуоресценции.

Рис. 1. Структурная схема флуоресцентного лидара
Флуоресцентное излучение поступает в приемную оптическую систему и направляется на вход спектрофотометра (монохроматора). Регистрируется или весь спектр флуоресценции в видимом и ближнем ИК диапазонах или измеряется интенсивность излучения флуоресценции на нескольких динах волн, например, на трех длинах волн: 685, 740 и 532 нм. Первые две длины волны обусловлены флуоресценцией хлорофилла типа «а» и «б» соответственно. Третья длина волны необходима для нормировки принятого излучения флуоресценции. С выхода спектрофотометра излучение по оптоволокну направляется в блок фотоэлектронных умножителей (ФЭУ), используемых в качестве фотодетекторов. Далее электрические сигналы направляются на аналого-цифровой преобразователь (АЦП). С выхода АЦП цифровая информация направляется в компьютер, где осуществляются предварительная обработка и запись накопленных сигналов.
Типичные характеристики приемника и лазерного источника излучения флуоресцентного лидара показаны ниже в таблице.
Характеристики приемника и лазерного источника излучения флуоресцентного лидара
Длина волны лазера, нм | 532 |
Длина волны регистрации, нм | 400-800 |
Длительность импульса, нс | 10-15 |
Расходимость пучка излучения, мрад | 6 |
Энергия лазерного импульса, мДж | 10-20 |
Диаметр приемного телескопа, см | 15 |
Достижимой на современном уровне техники является дальность регистрации флуоресцентного сигнала 50-150 м, на такой дальности сигналы флуоресценции от растительных объектов имеют значительную амплитуду. Использование флуоресцентных лидаров на такой дальности позволяет использовать самолетное зондирование (в отдельных публикациях сообщается о дальности зондирования 500 – 1000 м).
В настоящее время исследовались такие стрессовые факторы, как недостаток питательных веществ (калия, азота, фосфора, кальция, железа, магния), недостаток воды и загрязнение почвы растения нефтепродуктами. В зависимости от воздействия этих факторов спектр флуоресценции растительности существенно менялся: появлялось ослабление или увеличение интенсивности флуоресценции на определенных длинах волн.
На рис. 2 [3] показан спектр лазерной индуцированной флуоресценции кукурузы при дефиците калия. В работе [3] представлены результаты лабораторных исследований влияния недостатка калия в кукурузе, воды в соевых бобах и приведены спектры флуоресценции этих растений в различных ситуациях.

Рис. 2 Спектр флуоресценции кукурузы при дефиците калия
В качестве источника возбуждения в [3] использовался импульсный азотный лазер MolectronUV22 с длиной волны возбуждения 337 нм, частотой 30 Гц и выходной мощностью 9 мДж (флуктуации выходной мощности в течение эксперимента не более чем 3 %). Дистанция измерения – 1 м. Фокусное расстояние фокусирующего телескопа – 180 мм. Излучение флуоресценции регистрировалось фотоэлектронным умножителем HamamatsuR666.
В эксперименте использовались растения, выросшие в омываемом песке, который богат всеми питательными веществами, за исключением калия. Отсутствие калия является причиной уменьшения эффективности фотосинтеза и как следствие этого - увеличения интенсивности излучения флуоресценции на длинах волн 740 и 690 нм, что хорошо видно из рисунка 2.
На Рис. 3 [3] представлен спектр флуоресценции соевых бобов при недостатке воды. Недостаток воды в соевых бобах приводит к возрастанию флуоресценции на длинах волн 440, 525, 690 и 740 нм. Увеличенная флуоресценция хлорофилла (так же как в опыте с недостатком калия) указывает на ослабление фотосинтеза.

Рис. 3 Флуоресцентный спектр дегидрированных листьев сои
Исследования, проведенные в [3], показывают, что подавление фотосинтеза растений является причиной возрастания флуоресценции на длинах волн 690 и 740 нм. Кроме недостатка воды и калия причиной этого может быть и хлороз (заболевание растения, связанное с уменьшением концентрации хлорофилла). Это заболевание также приводит к увеличению интенсивности флуоресценции на длинах волн 690 и 740 нм. Хлороз может быть результатом различных факторов, например, заражения растения грибами или насекомыми, обезвоживания и отсутствия питательных веществ.
Влияние недостатка различных питательных веществ на спектр флуоресценции кукурузы изучалось в работе [4]. В качестве источника возбуждении использовался азотный лазер MolectronUV22, излучающий на длине волны 337 нм. Кукуруза была выращена в парниках в песчаной земле (белый кварцевый песок).
Отмечается, что недостаток некоторых питательных веществ может привести к видимым изменениям в состоянии растения, например, к ослаблению роста или, напротив, к аномально быстрому развитию. Но видимые симптомы иногда сложно идентифицировать в полевых условиях и связать их с недостатком питательных веществ из-за воздействия на растения многих факторов (погода, заболевание растения, заражение насекомыми). Однако, недостаток питательных веществ может быть зарегистрирован при помощи метода лазерно-индуцированной флуоресценции.
Рисунки 4- 6 [4] показывают как недостаток различных питательных веществ ведет к изменениям в спектре флуоресценции растений).

Рис. 4. Воздействие недостатка питательных веществ на интенсивность флуоресценции на 440 нм
На рисунках 4-6 введены следующие обозначения: 1 – полный набор питательных веществ (элементов); 2 - недостаток калия; 3 - недостаток кальция; 4 – недостаток фосфора; 5 – недостаток азота; 6 – недостаток магния; 7 - недостаток серы; 8 – недостаток железа.
Интенсивность флуоресценции уменьшается на 440 нм при недостатке калия, фосфора, азота, железа и магния, незначительные изменения в спектре на 440 нм наблюдались при дефиците серы, кальция и фосфора.

Рис. 5. Воздействие недостатка питательных веществ на интенсивность флуоресценции на 690 нм
Дефицит азота, фосфора и железа приводит к уменьшению излучения флуоресценции на 690 и 740 нм (см. рисунки 5 и 6). Отсутствие калия увеличивает флуоресценцию на 690 и 740 нм более чем втрое (вместе с небольшим уменьшением флуоресценции на 440 нм).

Рис. 6. Воздействие недостатка питательных веществ на интенсивность флуоресценции на 740 нм
Влияние избытка железа и кальция на спектр флуоресценции кукурузы и влияние загрязнения почвы нефтепродуктами на спектр флуоресценции кедра исследовалось в работе [6].
В качестве источника возбуждения использовался лазер на иттрий алюминиевом гранате, активированном трехзарядными ионами неодима, длительность лазерного импульса 15 нс и длина волны излучения 1064 нм (исходное лазерное излучение преобразовывалось во вторую гармонику с длиной волны 532 нм). Энергия одного импульса не превышала 0,2 Дж при частоте повторения 5 Гц.
Для эксперимента были взяты 15-20 дневные образцы кукурузы, выращенные в различных почвах. Первая группа была выращена в растворе (питательной смеси) Кнопа, вторая группа была также выращена в этом растворе, но без содержания железа. Лабораторные эксперименты продемонстрировали, что с изменением в минеральном питании, происходит трансформация флуоресцентного спектра растения. Для лабораторных измерений использовался флуорометр с мягкой ксеноновой лампой, два монохроматора, набор фильтров и персональный компьютер.
Спектры флуоресценции кукурузы в зависимости от разных условий питания показаны на Рис. 7 [6]. Из рисунка хорошо видно, что величина интенсивности первой группы намного ниже (раствор Кнопа - пунктирная серая линия), чем второй группы (дефицит железа – сплошная серая линия) и третьей (стресс, связанный с минеральным питанием – сплошная черная линия).
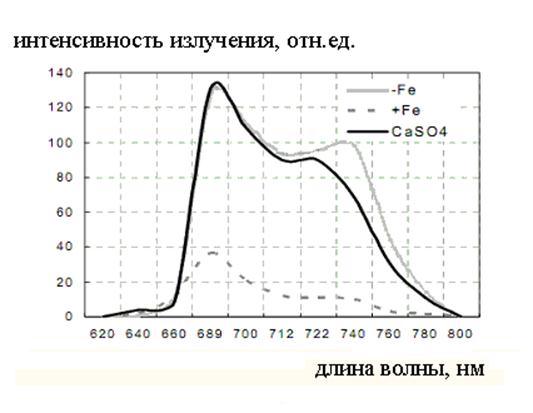
Рис. 7. Спектры флуоресценции кукурузы в зависимости от разных условий питания
Сотрудниками ИОА СО РАН проводился цикл экспериментов с деревьями в Восточной Сибири (кедр) [5-8,11]. Исследовалась зависимость отношения f интенсивностей флуоресценции на длинах волн 685 и 740 нм от степени загрязнения почвы нефтяными продуктами. После каждых 10 дней после каждого полива нефтепродуктами наблюдалось изменение концентрации хлорофилла в иголках кедра.
После первого полива нефтепродуктами в первый период наблюдения за растением не было замечено никаких видимых изменений. После трех дней флуоресцентная реакция увеличилась (отношение f увеличилось с 1,82 до значения 2,64). Возрастание квантового выхода флуоресценции являлось следствием понижения эффективности основных фотосинтетических процессов. При нормальной активности на начальной стадии фотосинтеза, вся поглощенная энергия тратится на фотосинтетические процессы. При стрессе, т.е. в тормозящих фотосинтез условиях, поглощенная энергия света не полностью тратится на фотосинтез, поэтому интенсивность флуоресценции возрастает. Растение регулирует свою первоначальную реакцию фотосинтеза для того, чтобы замедлить генерацию продуктов фотосинтеза в ситуации, когда невозможно расходовать их. Высокая фотосинтетическая активность не нужна, если растение страдает дефицитом минеральных питательных веществ.
Второй полив составлял 30 мл на образец. К концу десятидневного периода, у растений появились первые пожелтевшие иголки у основания кроны. В это время интенсивность их флуоресценции снижается на 60 %. Это объясняется с одной стороны разрушением хлорофилла, а с другой стороны новым режимом биологической системы, перенесшей адаптацию.
Следующий полив составил 50 мл на образец. За это время, образцы имели заметные изменения такие, как сбрасывание иголок. Флуоресцентный сигнал в экспериментальных образцах стал на 50 % ниже, чем во втором цикле и на 200 % ниже, чем величина f для здоровых образцов. Стабильное уменьшение отношения f обусловлено уменьшением концентрации хлорофилла и разрушением фотосинтетического аппарата. Когда уровень стресса выше способности адаптации биологической системы, организм растения реагирует ухудшением эффективности, это из-за того, что чрезмерная, сокращающая жизнь перегрузка заставляет упрощать фотосинтетический аппарат растения, и оно деградирует. В результате применение 70 мл дозы нефтепродуктов на образец приводит к его высыханию, деформации и к пожелтению его иголок – к смерти растения.
На Рис. 8 [6] показан флуоресцентный спектр контролируемых образцов кедра и образцов кедра, при воздействии на них нефтепродуктов. Видно возрастание интенсивности флуоресценции на 685 нм, по сравнению с интенсивностью на 740 нм, что объясняется низкой фотосинтетической эффективностью.

Рис. 8 Флуоресцентный спектр контролируемых образцов кедра и образцов кедра, при воздействии на них нефтепродуктов
Влияние азота на флуоресцентный спектр березы и кедра исследовалось в работах [7, 8]. Опыты проводили с 5-7 летними саженцами кедра сибирского и березы бородавчатой. Растения помещали на расстоянии 70 м от флуоресцентного лидара. Азот вносили четыре раза с интервалом пять дней. В качестве загрязняющего вещества использовали аммиачную селитру, которая в зависимости от содержания может проявить себя и как удобрение и как загрязняющее вещество. Экспериментальные растения были поделены на три группы. В почву растений первой группы удобрения не вносились, эти образцы предназначались для контрольных измерений. В почву второй группы была внесена оптимальная доза удобрения, определенная согласно предварительными исследованиями, а в почву третьей группы – высокая. Содержание хлорофилла в листьях и хвое определяли с использованием спектрофотометра UV-1601 PC.
Содержание хлорофилла в хвое кедра сибирского при оптимальных дозах удобрения резко увеличивается после первой подкормки и почти не отличается от концентрации хлорофилла контрольной группы при дальнейшем внесении удобрений. Такое устойчивое содержание пигментов в хвое связано с особенностями азотного метаболизма у хвойных. Избыточное азотное питание снижает содержание фотосинтетических пигментов в хвое кедра. Совсем по-другому влияют азотные подкормки на пигментный фонд березы бородавчатой. Внесение оптимальных доз удобрения, как и у кедра, не вызывает значительных изменений в содержании фотосинтетических пигментов, однако уже на второй день проявляется в характеристиках лазерно-индуцированной флуоресценции.
При отсутствии видимых признаков воздействия удобрений наблюдаются значительное увеличение отношения интенсивности сигналов флуоресценции на длинах волн 685 нм и 740 нм для оптимальной и высокой концентрации азотосодержащих веществ в почве, свидетельствующее о начальных этапах отклонения от функциональной нормы и о снижении жизнеспособности растения.
Далее с ростом воздействия удобрения происходит уменьшение сигнала флуоресценции, что связано с адаптационными процессами у растений в ответ на стрессовые условия.
Таким образом, анализ результатов имеющихся (пока немногочисленных) экспериментов показывает, что метод лазерной индуцированной флуоресценции может стать эффективным дистанционным (неконтактным) методом обнаружения стрессовых состояний растительности (являющихся индикаторами недостаточного уровня питательных веществ или наличия загрязнителей в почве) и требует дальнейшего развития и проведения экспериментальных исследований.
Литература
1. Detection of mecanical and disease stresses in citrus plants by fluorescence spectroscopy / J. Belasque [et al.] // Applied Optics. 2008. Vol. 47. No 11, Р. 1922-1926.
2. Cecchi G., Bazzani M., Pantani L. Fluorescence lidar method for remote monitoring of effects on vegetation // SPIE. 1995. Vol. 2585. Р. 49 - 56.
3. Laser-induced fluorescence of green plants. 1: A technique for the remote detection of plant stress and species differentiation / Emmett W. Chappelle [et al.] // Applied Optics. 1984. Vol. 23. No 1, Р. 134-138.
4. Laser-induced fluorescence of green plants. 2: LIF caused by nutrient deficiencies in corn / Emmett W. Chappelle [et al.] // Applied Optics. 1984. Vol. 23. No 1, Р. 139-142.
5. Fateeva N.L., Matvienko G. G. Application of the method of laser-induced fluorescence // Proc. of SPIE. 2004. Vol. 5232. Р. 652 - 657.
6. Fluorescence lidar method for remote monitoring of effects on vegetation / G. Matvienko [et al.] // Proc. of SPIE. 2006. Vol. 6367. Р. 63670F-1 - 63670F-8.
7. Исследование органического аэрозоля растительного происхождения с помощью флуоресцентного лидара / А.И. Гришин [и др.] // Оптика атмосферы и океана. 2007. Т. 20. № 4. С. 328 – 336.
8. Исследование лазерно-индуцированой флуоресценции хвойных и лиственных растений при азотном загрязнении почвы / Н.Л. Фатеева [и др.] // Оптика атмосферы и океана. 2006. Т. 19. № 2-3. С. 212 – 215.
9. Fluorescence lidar method for remote monitoring of effects on vegetation / Emmett W. Chappelle [et al.] // SPIE. 1997. Vol. 2959. Р. 1 - 10.
10. Luedeker W., Guenther K.P., Dahn H.-G. Laser induced fluorescence a tool for vegetation status- and stress- monitoring and optical aided agriculture // SPIE. 1997. Vol. 3059. Р. 63 - 75.
11. Комплексный стенд оптической диагностики биосистем / Б.Г. Агеев [и др.] // Оптика атмосферы и океана. 2007. Т. 20. № 2-3. С. 90 – 95.
Публикации с ключевыми словами: лазер, спектры флуоресценции, растения, дистанционный контроль, стрессовые ситуации
Публикации со словами: лазер, спектры флуоресценции, растения, дистанционный контроль, стрессовые ситуации
Смотри также:
- Метод классификации нефтяных загрязнений на земной поверхности, основанный на регистрации флуоресцентного излучения в пяти узких спектральных диапазонах
- Лазерный флуоресцентный метод классификации нефтяных загрязнений на земной поверхности, использующий нейросетевой алгоритм
- 77-30569/256187 Экспериментальные исследования спектров флуоресценции природных образования и нефтяных загрязнений
Тематические рубрики:
| Авторы |
| Пресс-релизы |
| Библиотека |
| Конференции |
| Выставки |
| О проекте |
| Телефон: +7 (915) 336-07-65 (строго: среда; пятница c 11-00 до 17-00) |
|
||||
| © 2003-2024 «Наука и образование» Перепечатка материалов журнала без согласования с редакцией запрещена Тел.: +7 (915) 336-07-65 (строго: среда; пятница c 11-00 до 17-00) | |||||



